ПОИСК

Кислород в природе. Воздух. Кислород — самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных.
Общее количество кислорода в земной коре близко к половине ее массы (около 47%). [c.374]
Кислорода в земной коре содержится больше, чем любого другого элемента. Он составляет 89% веса воды, 23% веса воздуха (21% по объему) и около 50% веса обычных минералов (силикатов). [c.
98]
Несмотря на широкую распространенность кислорода в земной коре, природа этого элемента стала известна значительно позднее некоторых других элементов.
Объясняется это известной трудностью выделения кислорода из большинства соединений, с одной стороны, и неправильными теоретическими представлениями, господствовавшими среди ученых продолжительное время, с другой стороны. Последнее обстоятельство хорошо видно из истории открытия кислорода. [c.148]
Сера также относится к числу весьма распространенных элементов (0,52%), хотя и сильно уступает в этом отношении кислороду. В земной коре сера встречается преимущественно в виде сульфидов некоторых металлов (железа, меди, цинка, свинца и др.), а также в виде сульфатов (главным образом, гипс). В меньших количествах она встречается в самородном состоянии. [c.139]
Кислород. Кислород является самым распространенным эле-ментом земной коры. В атмосфере его находится около 23 вес.%, в составе воды — около 89%, в человеческом организме — около 65%, в песке содержится 53% кислорода, в глине — 56% и т. д.
Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы. Свободный кислород со держится почти исключительно в атмосфере, причем количество его оценивается в 1,2-10т.
При всей громадности этой величины она не превышает 0,0001 общего содержания кислорода в земной коре. [c.47]
Литофильные, или оксифильные, элементы образуют твердые оболочки планет и наиболее распространены. Они образуют устойчивые соединения с кислородом.
В земной коре литофильные элементы образуют разнообразные минералы — силикаты, алюмосиликаты и др. По преимуществу это элементы с небольшой атомной массой (до 7=60).
В метеоритах они являются главными составными частями силикатной фазы. [c.428]
Распространенность в природе. Кислород — самый распространенный элемент на Земле. Массовая доля кислорода в земной коре равна 47,2 7о. он входит [c.127]
В воде содержится около 89″(i кислорода по весу, в организме человека— около 65%, в песке — около 53%. Общее количество кислорода в атмосфере достигает до 10 яг при всей огромности этой величины она составляет не более 0,0001 общего содержания кислорода в земной коре. [c.17]
Каких атомов — кремния или кислорода — больше в земной коре и во сколько раз Массовые доли кремния и кислорода в земной коре равны 27,6% и 47,2% соответственно. [c.15]
Кремний в природе. По распространенности в природе кремний занимает второе место (после кислорода). В земной коре на долю его приходится около 26%, в неживой природе кремний играет такую же важную роль, какую играет углерод в живой природе. Кремний в свободном состоянии в природе не встречается.
Он входит в состав многих минералов, представляющих собой кислородные соединения — окислы и соли кремневых кислот. Наиболее известные минералы — песок, кварц, горный хрусталь, кремень — состоят из двуокиси кремния ЗЮг полевые шпаты, слюда, глина, асбест и многие другие являются солями кремневых кислот. [c.
205]
Кремний по распространенности в земной коре занимает второе место после кислорода. В земной коре он находится в основ- [c.332]
Распространение в природе. Кислород является важнейшей для жизни, поддерживающей дыхание составной частью атмосферного воздуха. Содержание кислорода в сухом воздухе составляет 20,9 об.% или 23,0 вес.
%, причем в открытом пространстве содержание кислорода в воздухе очень мало изменяется (не более чем на 0,1%).
Несмотря на то что при дыхании и за счет процессов горения кислород непрерывно расходуется, его количество все ” время пополняется благодаря процессам фотосинтеза, происходящим в зеленом веществе растений на солнечном свету. Вода содержит 88,81 вес.
% кислорода, мировой океан — около 85,8% и доступная нам часть твердой земной коры — 47,3% (в форме окислов и кислородных солей). Общее” содержание кислорода в земной коре, океане и воздухе оценивают примерно в 50 вес. %, т. е. кислород принимает такое участие в строении земной коры (включая атмосферу), как все остальные элементы, вместе взятые. [c.662]
К вопросу о свободном кислороде в земной коре (Рукопись), 1931. 32 с. Архив АН, ф. 518, оп. I, № 44. [c.325]
Кремний —один из самых распространеиых элементов, занимающий второе место после кислорода. В земной коре содержится 27,6 % (по массе) кремния. [c.204]
Кислород. Содержание кислорода в земной коре, включая воду и воздух, составляет 49,4% это сахмый распространенный элемент. Свободный кислород находится в воздухе (20,9% по объему 23,2% по массе) и в растворенном состоянии в воде (7—10 мг л). Связанный кислород входит в состав воды (88,9%) и различных минералов. [c.176]
Химические методы выделения металлов вызывают особый интерес. Весовое содержание кислорода в земной коре составляет 50%, и поэтому неудивительно, что многие металлы находятся в природе в виде соединений с этим высокоэлектроотрицательным элементом.
Если металлы встречаются в природе в виде сульфидов, последние легко можно превратить в соответствующие окислы путем прокаливания на воздухе. Поэтому основной проблемой получения металлов является восстановление их окислов. В разд. 8.1. было отмечено, что движущей силой химической реакции является уменьщение ее свободной энергии. Эта величина, определяемая уравнением (8.
6), зависит от температуры, если энтропия изменяется существенно. Наиболее удобным способом представления таких данных о свободной энергии является графический метод (Эллингем, 1944), в котором изменение в зависимости от температуры для ряда реакций (на 1 моль общего реагента) изображают на одной диаграмме.
Все реакции в данном случае представляют собой восстановление окислов металлов, и поэтому общим реагентом является кислород. На рис. 9.1 приведена такая зависимость для некоторых наиболее важных металлов. [c.335]
Наиболее значительное воадействие живые тела, повидимому, оказали на состав земной атмосферы, которая содержит 75,5% азота, 23,0% кислорода и 0,03% двуокиси углерода по весу.
В ней находится l,2-10i x кислорода, что составляет только 0,01 % всего кислорода в земной коре.
В то же время половина всего азота на Земле находится в атмосфере, что обусловлено его малой химической активностью. [c.328]
Смотреть страницы где упоминается термин Кислород в земной коре: [c.30] [c.228] [c.148] Учебник общей химии 1963 (0) — [ c.418 ]
Кора
Корей
© 2018 chem21.info Реклама на сайте
Кислород в природе

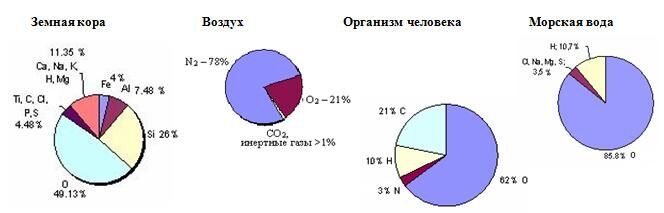
Легкий газ кислород — самый распространенный на Земле элемент. В земной коре его по весу в 12 раз больше, чем железа, в 140 раз больше, чем углерода, почти в 500 раз больше, чем серы; он составляет 49,13 процента от веса всей земной коры.
Такое распространение кислорода на Земле полностью отвечает его значению в жизни живой и мертвой природы.
Ведь вода — это соединение водорода с кислородом (содержит 89 процентов кислорода), песок — соединение кремния с кислородом (53 процента кислорода), железная руда — соединение железа с кислородом. Кислород входит в состав многих руд и минералов.
Но наибольшее значение имеет кислород для жизни живой природы, для жизни животных и человека. Без кислорода жизнь на Земле невозможна.
Вся жизнедеятельность человеческого организма, начиная с рождения и кончая смертью, связана с окислительными процессами, в которых главную роль играет кислород.
Эти процессы начинаются с дыхания человека. Вдыхаемый человеком воздух поступает в легкие. Здесь через стенки тончайших кровеносных сосудов, через которые не проходит жидкость, но проходит газ, кислород проникает в кровь. В крови происходит важнейший для жизни процесс газообмена.
Кровь, поглощая кислород, выделяет содержащийся в ней углекислый газ. Обычно воздух содержит 0,03 процента углекислого газа, выдыхаемый же человеком воздух имеет в своем составе 4,38 процента углекислого газа.
Таким образом, содержание углекислого газа в выдыхаемом человеком воздухе увеличивается в 140 раз по сравнению с его содержанием в воздухе. Содержание же кислорода, наоборот, падает до 16,04 процента, то есть на 1/5 по сравнению с его содержанием в воздухе.
Полученный кровью кислород разносится по всему телу и окисляет растворенные в ней питательные вещества.
При окислении кислородом, то есть при медленном сгорании питательных веществ, поступающих в организм, образуется углекислый газ, который поглощается циркулирующей кровью.
Углекислый газ кровью приносится к легким и здесь, при новом газообмене с поступившим свежим кислородом воздуха, при выдыхании выбрасывается в окружающую атмосферу.
Взрослый человек ежедневно поглощает в процессе дыхания примерно 850 литров кислорода. Окислительные процессы, идущие в нашем организме, сопровождаются выделением тепла. Это тепло, связанное с процессом дыхания, и поддерживает температуру нашего тела на уровне примерно 37 градусов.
При дыхании, при горении, при любых других окислительных процессах (ржавление металлов, гниение и т. д.) идет поглощение кислорода воздуха. Могут возникнуть законные вопросы: не беднеет ли воздух кислородом, надолго ли его хватит для жизни на Земле? Для беспокойств в этом отношении нет повода.
В атмосфере содержится 1 300 000 000 000 000 тонн кислорода, и хотя эта величина составляет лишь одну десятитысячную общего содержания кислорода в земной коре, это число достаточно велико. Но самое главное заключается в том, что оно практически не изменяется благодаря идущим в природе обратным процессам выделения кислорода.
Эти процессы выделения кислорода происходят в результате жизнедеятельности растений. Поглощая из воздуха углекислый газ для своего питания, растения под действием солнечных лучей разлагают его на углерод и кислород.
Углерод остается в растении и идет на построение его организма, кислород же выделяется обратно в атмосферу.
И хотя растения также дышат, и им для дыхания необходим кислород, но в общем то количество кислорода, которое растения выделяют при своем питании, в 20 раз больше того, которое им необходимо для дыхания. Таким образом, растения — это живые фабрики кислорода.
Вот почему посадки растений в городах имеют большое оздоровительное значение. Они не только поглощают избыточные количества углекислого газа, накопляющегося здесь в результате действия фабрик и заводов, но, содействуя очистке воздуха от вредных примесей, они обогащают его живительным для организма человека и животных кислородом.
Зеленое кольцо вокруг городов—это источник кислорода, источник здоровья.
Презентация к уроку по химии (8 класс) на тему: Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства

Слайд 1
«Кислород – это самый распространенный на нашей планете элемент. Он рождает теплоту человеческого дыхания и обжигающее пламя пожара» Подготовила: Овчинникова Н.И. учитель химии МБОУ «Верхнепокровская СОШ»
Слайд 2
Тема: Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства.
Слайд 3
Актуализация опорных знаний Определенный вид атомов — … (химический элемент). Вещества, состоящие из нескольких видов атомов, называются… (сложными). Свойство атомов удерживать определенное число других атомов в соединении — … (валентность).
Условная запись вещества, отражающая его количественный и качественный состав, называется… (химической формулой). Вещества, образованные одним видом атомов, называются… (простыми). Химически неделимая частица — … (атом). Запись химической реакции с помощью химических формул — это… (уравнение химической реакции).
«Масса веществ, вступивших в реакцию, равна массе образующихся веществ» — это формулировка… (закона сохранения массы веществ при химических реакциях). Самое распространенное вещество на Земле —… (вода). Явления, при которых происходит превращение одних веществ в другие, называются… (химическими).
Образование осадка, выделение газа, изменение окраски, выделение теплоты, появление запаха — все это… (признаки химической реакции).
Слайд 4
Усвоение новых знаний 1. Кислород как элемент План характеристики химического элемента 1. Химический знак. 2. Относительная атомная масса. 3. Валентность. 4. Распространенность элемента в природе.
Слайд 5
Кислород как элемент 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16. 2. Валентность II , степень окисления -2 (редко +2; +1; -1). 3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов.
Слайд 6
2. Кислород как вещество План характеристики простого вещества 1. Химическая формула. 2. Относительная молекулярная масса. 3. Физические свойства. 4. Химические свойства. 5. Применение. 6. Способы получения в лаборатории и в промышленности. 7. Нахождение в природе.
Слайд 7
Историческая справка В1774г. англичанин Джозеф Пристли (пастор по профессии, ученый по складу ума) получил кислород и тщательно исследовал его свойства
Слайд 8
О своем открытии Пристли сообщил другу – французу А. Л. Лавуазье. Тот отличил полученный газ от обычного воздуха и дал ему название «жизненный воздух», а позже – кислород. В 1777 г.
Лавуазье выпускает книгу, в которой описывает опыты по получению кислорода, и в тот же год публикуется работа шведского аптекаря Карла Шееле. Он изучал «жизненный воздух» еще в 1771-1772 гг.
, но из-за материальных затруднений не смог выпустить описание своих экспериментов.
Слайд 9
Физические свойства кислорода. Кислород О 2 Газ, без цвета, вкуса и запаха. Чуть тяжелее воздуха. Мало растворим в воде.
Слайд 10
Способы получения и собирания кислорода. Кислород в природе образуется в процессе фотосинтеза. В промышленности его получают перегонкой сжиженного воздуха при t = – 183 0 С.
Слайд 11
В лаборатории кислород получают реакциями разложения: а) воды под действием электрического тока (электролиз): 2 H 2 O → 2H 2 + O 2 б) пероксида водорода под действием MnO 2 : MnO 2 2Н 2 О 2 → 2Н 2 О + О 2 в) перманганата калия при нагревании: 2 KMnO 4 → K 2 MnO 4 + MnO 2 + O 2 Разложение этой соли идёт при нагревании её выше 200 0 С.
Слайд 12
Получение кислорода , проверка его наличия тлеющей лучиной
Слайд 13
Нахождение кислорода в природе Кислород может находиться в атмосфере (21% по объему), в земной коре (47% по массе), в живых организмах (65% по массе), в гидросфере (89% по массе). В целом 99,99% кислорода «связано» в виде соединений, 0,01% – свободное простое вещество.
Кажется, что это очень небольшое количество, но на самом деле на 0,01% приходится 1,5'1015 тонн! Весь свободный кислород образуется на планете благодаря зеленым растениям. «Связывание» кислорода происходит в результате дыхания (живая природа) и горения (неживая природа).
Слайд 14
1. Каким символом обозначают: а) элемент кислород, б) атом кислорода, в) молекулу кислорода, д) простое вещество — кислород? 2. Какой из химических элементов наиболее распространен в земной коре? 3. Укажите значение: а) относительной атомной массы кислорода, б) относительной молекулярной массы кислорода, в) молярной массы атомов кислорода, г) молекулярной массы кислорода. 4.
Укажите, когда речь идет о кислороде как об элементе и когда как о простом веществе: а) чистая вода содержит 88,9% кислорода по массе; б) воздух содержит 21 % кислорода по объему; в) кислород входит в состав белков, жиров, углевод» и многих других органических веществ; г) человеку для дыхания в течение 1 часа надо 30 л кислорода, д) атом кислорода; е) газообразный кислород.
Слайд 15
Кислород в природе В земной коре его 49%, в воде – 89 %. В составе воздуха (в виде простого вещества) – 20-21% по объёму. Состав воздуха: О 2 – 20-21 %; N 2 – 78 %; CO 2 – 0,03 %, остальное приходится на инертные газы, пары воды, примеси.
Слайд 16
Домашнее задание § 18, 19, ответить на вопросы 1-3 стр. 59
Слайд 17
Рефлексия “ Я прожил этот час не зря, потому что……
Слайд 18
Успехов вам !
Кислород в недрах земли

Примкнем к геологической экспедиции, выехавшей для исследования недр в один из районов нашей страны.
Экспедиция разбивается на отдельные партии — отряды.
Рано утром расходятся геологи по заранее намеченным маршрутам.
Геологи-разведчики при помощи буровых инструментов извлекают образцы пород из различных глубин земной коры и собирают на поверхности земли скальные породы.
Гидрогеологи занимаются исследованием водоносных горизонтов грунтовых и поверхностных вод. Вечером, вернувшись в свои походные палатки-лаборатории, они производят анализы добытых за день образцов.
Перед нами принесенные геологами образцы пород, содержащих кремний. Кремний по распространенности в природе занимает второе место, после кислорода. Около 30 процентов веса земной коры состоит из кремния. Но в природе кремний встречается не в свободном состоянии, а в соединении с кислородом (SiO2), которое химики называют кремнеземом, а геологи — кварцем.
Земная кора на 65 процентов состоит из кремнезема. Известны многочисленные разновидности этого соединения. Кремний, кварц, горный хрусталь, простой песок, точильный камень, различные драгоценные камни — все это родные братья кремнезема.
А как многообразно используется кремнезем в быту и в технике! Чайная и столовая посуда, сделанная из стекла, хрусталя, фарфора и фаянса, кирпичные здания, железобетонные сооружения и перекрытия, мосты, широкие полотна автострад, гранитные облицовки величественных зданий и набережных состоят главным образом из соединений кремния и кислорода.
Еще задолго до того, как человек начал использовать кремний в технике, в природе растения использовали его для своей жизни.
Прочность стебля растений обусловлена наличием в нем кремния и кислорода. В золе сгоревшей соломы или трубок бамбука мы находим много кремнезема, который при жизни растений настолько укрепляет их стебли, что они способны устоять против сильных порывов ветра и грозовых ливней.
Декоративные растения подкармливают специальными растворами солей кремнезема, чтобы укрепить их стебли и лепестки цветка. Такие растения можно перевозить на далекие расстояния.
Часто геологи-разведчики приносят с собой в палатку светлосерый камень — известняк, одну из кристаллических разновидностей углекислого кальция (СаСO3).
В состав углекислого кальция входит 48 процентов кислорода, 40 процентов кальция и 12 процентов углерода. Из этих же элементов состоят мел и мрамор — другие разновидности углекислого кальция.
Рассматривая известняк через лупу, иногда на его срезах можно заметить очертания раковин морских животных.
На необъятных просторах земли идет постоянный процесс превращения нерастворимого в простой воде углекислого кальция в растворимый.
Потоки воды, насыщенные углекислым газом и содержащие углекислоту (Н2O+СO2— Н2СO3), встречают на своем пути углекислый кальций (СаСО3) и, вступая с ним во взаимодействие (СаСО3 + Н2СO3 — Са(НСO3)2), образуют соль, которая растворяется в воде и уносится в море.
Для беспозвоночных животных, которые живут в морях и океанах, соли служат материалом для построения их наружного покрова — раковинок. Раковинки погибших животных скопляются на дне моря, постепенно образуя мощные слои известняка и мела.
Геологи считают, что те пространства земли, на которых сейчас встречаются огромные массивы известняка и мела, были когда-то морским дном.
При постройке зданий и сооружений известняк используется как строительный материал. Из известняка можно изготовить облицовочные плиты.
Большое количество известняка в Советском Союзе используется для получения другого ценного строительного материала — негашеной извести. Если углекислый кальций прокалить, он разлагается на известь и углекислый газ (СаСО3 — CaO + СO2). Всю негашеную известь и почти весь углекислый газ получают из известняка, прокаливая его в специальных печах.
Геологи-разведчики принесли в палатку-лабораторию образцы невзрачной на вид, но чрезвычайно ценной руды, состоящей из гидратов окиси алюминия: Аl(ОН)3 и Аl(ОН). Смесь этих кислородных соединений алюминия носит название бокситов. Они состоят из алюминия, водорода и кислорода. Из бокситов получают окись алюминия (А12O3), которую в технике называют глиноземом.
Глинозем является основным сырьем для производства алюминия.
Но чтобы получить алюминий, нужен еще и криолит — фтористая соль натрия и алюминия. Криолит в природе встречается редко, но его можно получить искусственным путем.
Алюминий получают электролизом в специальных ваннах, в которые загружают криолит и глинозем. Под действием постоянного тока температура в ванне повышается настолько, что криолит расплавляется. В расплавленной массе криолита растворяется глинозем.
В растворе глинозема под действием постоянного электрического тока идет электролиз. Алюминий выделяется на графитовых стенках ванны, к которым подведен отрицательный полюс источника тока, а кислород, выделяясь на положительных графитовых электродах, постепенно сжигает их в двуокись углерода.
На дне ванны скопляется расплавленный алюминий, который сливают через специальные отверстия.
Так из бокситов получают серебристо-белый металл, который обладает ценнейшими свойствами.
Сплав из 95 процентов алюминия и небольшого количества меди, магния и железа — дюралюмин — прочен, легок, почти в 3 раза легче железа.
Дюралюмин покрывают очень тонким слоем чистого алюминия, чтобы предохранить его от разрушения на воздухе — коррозии.
Это объясняется не тем, что алюминий вовсе не окисляется кислородом воздуха в присутствии влаги, а тем, что при своем окислении алюминий покрывается тонкой пленкой окиси, которая и предохраняет его от дальнейшего разрушения.
Из алюминиевых сплавов изготовляют детали самолетов, части к автомобилям и другим машинам. Из них делают кухонную посуду, мебель, применяют в жилищном строительстве. Порошок алюминия входит в состав красок.
При нагревании алюминий жадно поглощает кислород, образуя окись алюминия. Реакция происходит с большим выделением тепла.
Этим свойством алюминия пользуются в технике.
Алюминиевый порошок смешивают с магнитной окисью железа (Fe3O4) и поджигают. Образуется высокая температура, при которой легко плавится металл. Такая смесь носит название термита и применяется для сварки трамвайных рельсов и других железных и стальных изделий.
Термит используется и для военных целей. Им заполняют специальные зажигательные артиллерийские снаряды и авиационные бомбы.
В виде металла алюминий нигде в природе не встречается. Но в различных кислородных соединениях он находится во всей земной коре.
Не вся земная кора доступна изучению. Современная геологическая техника позволяет исследовать ее на глубине 16—18 километров.
Алюминий составляет примерно 10 процентов веса земной коры, доступной исследованию. Он встречается не только в виде бокситов — он входит в состав глины, слюды и полевых шпатов. Во всех этих соединениях алюминий связан с кислородом.
Окись алюминия часто встречается в природе в виде минерала. К наиболее твердым минералам относится корунд, из которого изготовляют точильные камни и который входит в состав наждака.
Корунд и наждак — серые камки, мало привлекающие взгляд человека.
Встречаются и очень красивые природные драгоценные камни, состоящие из алюминия, кислорода и незначительной примеси хрома, титана или железа.
Прекрасный рубин сверкает своим яркокрасным светом потому, что к природной окиси алюминия примешаны незначительные следы хрома.
Такие же ничтожные количества других металлов, подмешанные к глинозему, превращают его в природе в зеленый изумруд или фиолетовый аметист.
Сейчас человек уже разгадал тайны природы и научился искусственным путем в специальных печах при высокой температуре изготовлять некоторые драгоценные камни, которые не только идут на украшения, но и применяются в технике.
В недрах земли находится еще одно кислородное соединение — магнитная окись железа (Fe3O4). В технике эту руду называют магнитным железняком. В земной коре его насчитывается до 5 процентов.
Магнитный железняк залегает огромными массивами. На Урале из него состоят целые горы: Магнитная, Высокая и Благодать. Руда эта составляет смесь закиси железа (FeO) и окиси (Fe2O3). Поэтому часто магнитный железняк называют закись-окись железа.
В природе часто встречается и другая разновидность железной руды — окись железа (Fe2O3), или красный железняк. Почти вся донецкая металлургическая промышленность снабжается этой рудой. Огромные запасы ее находятся в районе Кривого Рога и Курска.
Окись железа входит в состав бурого железняка — водной окиси железа бурого цвета. Залежи бурого железняка разрабатываются на Южном Урале, в Керчи и других местах Советского Союза.
СССР занимает первое место в мире по запасам железной руды. Больше половины всех мировых запасов железа падает на территорию Советского Союза.
В состав большинства полезных ископаемых, встречающихся в недрах земли, в том или ином виде входит кислород. Его можно встретить в химическом соединении с легкими элементами, включая магний и алюминий, в соединении с тяжелыми элементами, включая уран, с щелочными металлами — натрием и калием, с щелочноземельными металлами — кальцием, стронцием и барием и в соединении с редкими элементами.
Кислород — самый распространенный элемент на земле.
Много труда положили ученые, чтобы определить, сколько кислорода находится в природе. В настоящее время принято считать, что половину веса земной коры, воздуха, воды, животных и растительных организмов составляет кислород, а вторую половину — все остальные элементы периодической системы Менделеева.
Кислород и его характеристики

Кислород – самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Массовая доля кислорода в земной коре составляет около 47%.
В виде простого вещества кислород представляет собой бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oС растворяют 4,9, а при 20oС – 3,1 объема кислорода.
Атомная и молекулярная масса кислорода
Относительная атомная масса атомарного кислорода равна 15,999 а.е.м.
Это безразмерная величина.Известно, что молекула кислорода двухатомна – О2. Относительная молекулярная масса молекулы кислорода будет равна:
Mr(О2) = 15,999 × 2 ≈32.
Аллотропия и аллотропные модификации кислорода
Кислород может существовать в виде двух аллотропных модификаций – кислорода О2 и озона О3 (физические свойства кислорода описаны выше).
При обычных условиях озон – газ. От кислорода его можно отделить сильным охлаждением; озон конденсируется в синюю жидкость, кипящую при (-111,9oС).
Растворимость озона в воде значительно больше, чем кислорода: 100 объемов воды при 0oС растворяют 49 объемов озона.
Образование озона из кислорода можно выразить уравнением:
3O2 = 2O3 – 285 кДж.
Изотопы кислорода
Известно, что в природе кислород может находиться в виде трех изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%). Их массовые числа равны 16, 17 и 18 соответственно. Ядро атома изотопа кислорода 16O содержит восемь протонов и восемь нейтронов, а изотопов 17O и 18O– такое же количество протонов,девять и десять нейтронов соответственно.
Существует двенадцать радиоактивных изотопов кислорода с массовыми числами от 12-ти до 24-х, из которых наиболее стабильным является изотоп 15О с периодом полураспада равным 120 с.
Ионы кислорода
На внешнем энергетическом уровне атома кислорода имеется шесть электронов, которые являются валентными:
1s22s22p4.
Схема строения атома кислорода представлена ниже:
В результате химического взаимодействия кислород может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
О0+2e → О2-;
О0-1e → О1+.
Молекула и атом кислорода
Молекула кислорода состоит из двух атомов – О2. Приведем некоторые свойства, характеризующие атом и молекулу кислорода:
| Энергия ионизации атома, эВ | 13,41 |
| Относительная электроотрицательность | 3,44 |
| Радиус атома, нм | 0,060 |
| Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 498 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Кислород

Общие сведения о кислороде
Кислород (лат. Oxygenium) впервые исследовал шведский химик К. Шееле в 1772 году. Это самый распространенный на Земле химический элемент. Массовая доля кислорода в земной коре примерно 49 %. Кислород встречается в природе в свободном (составная часть воздуха) и в связанном состоянии (вода, различные минералы, растения и животные).
Кислород в нормальных условиях – газ без цвета и запаха, аллотропная модификация – озон, газ с характерным резким запахом.
Кислород малорастворим в воде (примерно 1 объем на 20 объемов воды). При температуре –183°C кислород образует в синеватую жидкость, а при –219°C превращается в темно-синие кристаллы.
Кислород очень широко используется в технике, металлургии (при выплавке чугуна и стали, в производстве цветных металлов), для получения высоких температур при сварке металлов.
Кислород применяется в медицине и в дыхательных приборах. Жидкий кислород используется как окислитель топлива в реактивных двигателях. Вместе с азотом и некоторыми другими газами кислород образует атмосферу Земли.
Кислород играет важнейшую роль в жизни человека и животных.
Получение кислорода
В лаборатории:
- Разложением перманганата калия при нагревании:
2KMnO4 = K2MnO4 + MnO2 + O2
Также в аналогичных реакциях разложения используют сурик Pb3O4, оксид ртути HgO, бертолетову соль КСlO3.
- Разложением пероксида водорода:
2H2O2 = 2H2O + O2
- В результате процесса фотосинтеза:
6CO2 + 6H2O = C6H12O6 + 6O2
В промышленности:
- Сжижением воздуха с помощью холодильных машин, далее, используя различие температур кипения кислорода (–183°C) и азота (–196°C), выделяют кислород.
- Чистый кислород получают электролизом воды. Это очень дорогой метод и поэтому мало распространен.
Химические свойства
В периодической системе кислород расположен в VI группе второго периода.
Атом кислорода содержит 8 электронов: 2 электрона на 1s2-орбитали и 6 на внешнем слое (электронная конфигурация 1s22s22р4). Только фтор может окислить кислород, образуя дифторид кислорода OF2.
Во всех остальных соединениях степень окисления кислорода –2. Важной особенностью строения молекулы O2 – наличие двух неспаренных электронов, что приводит к эффекту парамагнетизма, т. е.
свойству молекул ориентироваться в направлении магнитного поля.
Атомы кислорода образуют двухатомную молекулу с двойной связью. В обычных условиях молекулы кислорода устойчивы и на атомы не распадаются, поэтому молекулярный кислород высокой активностью не отличается.
Кислород – активный неметалл. Он образует соединения со всеми элементами, кроме гелия, неона и аргона. С галогенами, криптоном, ксеноном, золотом и металлами платиновой группы он не реагирует, и их соединения можно получить только косвенным путем. С остальными элементами кислород непосредственно взаимодействует, образуя оксиды, причем большинство реакций протекают с выделением тепла.
Так, при нагревании кислород взаимодействует с водородом, серой, углеродом, фосфором, образуя воду и оксиды:
2Н2 + О2 = 2Н2О
С + O2 = СO2
S + O2 = SO2
4Р + 5О2 = 2Р2О5
С галогенами кислород в реакцию не вступает.
Очень активно взаимодействуют с кислородом щелочные и щелочноземельные металлы с образованием оксидов (как правило, с литием), пероксидов (как правило, с натрием) и надпероксидов (как правило, с остальными щелочными металлами):
4К + О2 = 2К2О(KO2)
Ba + O2 = BaO2
С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg + O2 = 2MgO
Некоторые металлы в обычных условиях окисляются лишь с поверхности, так как образующаяся пленка оксида защищает металл. При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления (≈ 400°C) железные стружки сгорают в кислороде:
3Fe + 2O2 = Fe3O4
В кислороде горят также сложные вещества с образованием соответствующих оксидов:
CH4 + 2O2 = CO2 + 2H2O
Кислород

| Атомный номер | 8 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха голубоватая жидкость
(при низких температурах) |
| Атомная масса (молярная масса) |
15,9994 а. е. м. (г/моль) |
| Радиус атома | 60 (48) пм |
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p4 |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
| Электроотрицательность (по Полингу) |
3,44 |
| Электродный потенциал | |
| Степени окисления | -2, −1, 0 ,+1, +2, -½ |
| Плотность | 0,00142897 г/см³ |
| Молярная теплоёмкость | 29,4 Дж/(K·моль) |
| Теплопроводность | 0,027 Вт/(м·K) |
| Температура плавления | 54,8 K |
| Теплота плавления | 0,444 кДж/моль |
| Температура кипения | 90,19 K |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | моноклинная |
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å |
| Отношение c/a | — |
| Температура Дебая | 155 K |
| 15,9994 |
| [He]2s22p4 |
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (Oxygenium).
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Схема атома кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли первого августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO (t) → 2Hg + O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота.
Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов.
Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В.
Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (l'oxygène), предложенного А.
Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 %(по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе.
Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей.
Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий.
При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑
Катализатором также выступает MnO2.
Физические свойства
Холодная вода содержит больше растворенного O2
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Фазовая диаграмма O2
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .
β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å .
Ещё три фазы образуются при высоких давлениях:
δ-О2 интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;
ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 → 2K2O
2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 → 2NO2
Окисляет большинство органических соединений:
CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определенных условиях можно провести мягкое окисление органического соединения:
CH3CH2OH + O2 → CH3COOH + H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1. — Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 → Na2O2
— Некоторые окислы поглощают кислород:
2BaO + O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
H2 + O2 → H2O2
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2 -). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:
Na2O2 + O2 → 2NaO2
Озониды содержат ион O3 – со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 → КО3 + КОН + O2
Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 → O2PtF6
Фториды кислорода
Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
2F2 + 2NaOH → OF2 + 2NaF + H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Кислород поддерживает процессы дыхания, горения, гниения. В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3 (озон).
Применение кислорода
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»).
Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами.
Они образуются в процессе активирования или частичного восстановления кислорода.
Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037% и 0,204% от общего числа атомов кислорода на Земле.
Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов.
А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Дополнительная информация
Соединения кислорода Жидкий кислород
Озон
Кислород, Oxygenium, O (8)
Открытие кислорода (Oxygen, франц. Oxygene, нем. Sauerstoff) ознаменовало начало современного периода развития химии. С глубокой древности было известно, что для горения необходим воздух, однако многие века процесс горения оставался непонятным. Лишь в XVII в.
Майов и Бойль независимо друг от друга высказали мысль, что в воздухе содержится некоторая субстанция, которая поддерживает горение, но эта вполне рациональная гипотеза не получила тогда развития, так как представление о горении, как о процессе соединения горящего тела с некой составной частью воздуха, казалось в то время противоречащим столь очевидному акту, как то, что при горении имеет место разложение горящего тела на элементарные составные части. Именно на этой основе на рубеже XVII в. возникла теория флогистона, созданная Бехером и Шталем. С наступлением химико-аналитического периода развития химии (вторая половина XVIII в.) и возникновением «пневматической химии» — одной из главных ветвей химико-аналитического направления — горение, а также дыхание вновь привлекли к себе внимание исследователей. Открытие различных газов и установление их важной роли в химических процессах явилось одним из главных стимулов для систематических исследований процессов горения веществ, предпринятых Лавуазье. Кислород был открыт в начале 70-х годов XVIII в.
Первое сообщение об этом открытии было сделано Пристлеем на заседании Английского королевского общества в 1775 г. Пристлей, нагревая красную окись ртути большим зажигательным стеклом, получил газ, в котором свеча горела более ярко, чем в обычном воздухе, а тлеющая лучина вспыхивала.
Пристлей определил некоторые свойства нового газа и назвал его дефлогистированным воздухом (daphlogisticated air). Однако двумя годами ранее Пристлея (1772) Шееле тоже получал кислород разложением окиси ртути и другими способами. Шееле назвал этот газ огненным воздухом (Feuerluft).
Сообщение же о своем открытии Шееле смог сделать лишь в 1777 г.
В 1775 г. Лавуазье выступил перед Парижской академией наук с сообщением, что ему удалось получить «наиболее чистую часть воздуха, который нас окружает», и описал свойства этой части воздуха. Вначале Лавуазье называл этот «воздух» эмпирейным, жизненным (Air empireal, Air vital) основанием жизненного воздуха (Base де l'air vital).
Почти одновременное открытие кислорода несколькими учеными в разных странах вызвало споры о приоритете. Особенно настойчиво признания себя первооткрывателем добивался Пристлей. По существу споры эти не окончились до сих пор.
Подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г.
Лавуазье в соответствии с этим выводом ввел для кислорода новое название — кислото образующий принцип (principe acidifiant ou principe oxygine). Фигурирующее в этом сложном названии слово oxygine Лавуазье произвел от греч.- кислота и «я произвожу».